TGF-β signaling und die Blut-Retinaschranke
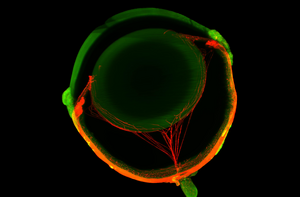
In unseren Arbeiten konnten wir zeigen, dass eine Deletion des TGF-β Signalwegs im gesamten Auge zum Phänotyp der diabetischen Retinopathie und der altersbedingten Makuladegeneration führt, was einen gemeinsamen molekularen Pathomechanismus nahelegt. Daten unserer Arbeitsgruppe zeigen dabei außerdem erstmalig, dass schon eine Hemmung des TGF-β Signalwegs im Gefäßendothel ausreicht, um zu dessen Proliferation zu führen. Das retinale Pigmentepithel (RPE), welches in unmittelbarer Nachbarschaft zur Choriokapillaris liegt, sezerniert hohe Mengen von TGF-β und dem Wachstumsfaktor vascular endothelial growth factor (VEGF). Bekannt ist, dass VEGF die Vitalität der Choriocapillaris sichert, während TGF-β eine überschießende Proliferation des Endothels unterdrückt. Im Bereich zwischen retinalem Pigmentepithel und Choriocapillaris benötigen wir also hohe Mengen TGF-β, um dem Entstehen choroidaler Neovaskularisationen, wie sie bei der altersbedingten Makuladegeneration vorkommen, entgegen zu wirken.
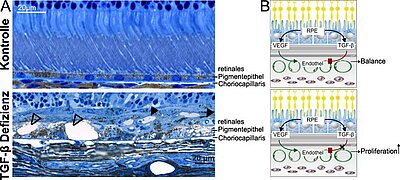
Abbildung: A. Semidünnschnitt des hinteren Augenabschnitts. Das Kontrolltier zeigt einen regelrechten Befund, wohingegen das Tier mit einer Defizienz des TGF-β Signalwegs ein mehrschichtiges retinales Pigmentepithel (RPE) mit zystischen Einschlüssen (offene Pfeilspitzen) und Gefäßanschnitten (schwarze Pfeilspitzen) aufweist. Das Schema in (B) beschreibt unsere aktuelle Arbeitshypothese. Abbildung B wurde von Antje Zenker gezeichnet und modifiziert nach (Schlecht et al. 2017).
Projektleiterin: Prof. Dr. Dr. Braunger
Projektmitarbeiter: Dr. Mario Vallon, Christina Bielmeier (MSc), Nikolai Kleefeldt (Weiterbildungsassistent der Universitätsaugenklinik Würzburg)