AG Neurovaskuläre Mechanismen
Team:
Dr. M. Vallon
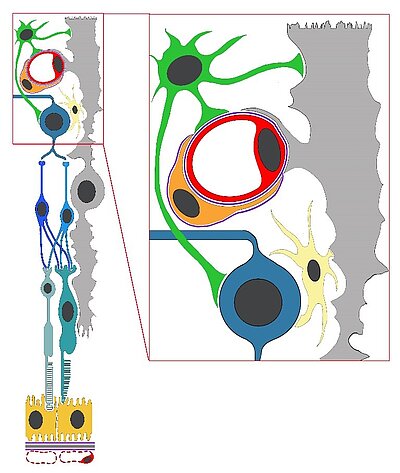
Abbildung: Skizze der Retina (links) und detaillierte Darstellung der neurovaskulären Einheit (rechts).
Folgende Zellen sind funktionell eng verbunden: Endothelzelle (rot) und Perizyt (orange), Astrozyt (grün) Müllerzelle (grau), Mikrogliazelle (gelb) und Neuron (blau).
Die Skizze wurde von PD Dr. N. Wagner gezeichnet
Neurale und vaskuläre Zellen des zentralen Nervensystems (ZNS) sind funktionell eng miteinander verbunden und bilden die sogenannte neurovaskuläre Einheit (s.h. Abbildung). Diese stellt einen essentiellen Bestandteil der Gewebshomöostase des ZNS dar. Dabei sichern die Blut-Retina- (BRS) bzw. Blut-Hirnschranke (BHS) sowie fein abgestimmte Interaktionen zwischen Endothelzellen, Basalmembran, Perizyten/glatten Muskelzellen, Gliazellen und Neuronen die Versorgung des neuronalen Gewebes mit Nährstoffen und schützt es vor toxischen Metaboliten. Bei Erkrankungen wie Diabetes mellitus, Frühgeborenenretinopathie, der altersbedingten Makuladegeneration, nach Schlaganfällen oder Hirntumoren ist das Zusammenspiel der einzelnen Zellpopulationen der neurovaskulären Einheit gestört. Ein Zusammenbruch der Schranken (BRS/BHS) führt oft zu sekundären Schäden wie Ödemen, Blutungen, Entzündungen und erhöhtem intrakranialen Druck. Dies führt im weiteren Verlauf zu einer (sekundären) Neurodegeneration und damit einhergehend einem Funktionsverlust des neuronalen Gewebes. In unserer wissenschaftlichen Arbeit fokussieren wir uns auf genetische und molekulare Mechanismen, die für die Entwicklung und die Aufrechterhaltung von Gefäßen sowie für neurodegenerative Erkrankungen des ZNS verantwortlich sind. Dabei ist eines der zentralen Forschungsziele unserer Arbeitsgruppe molekulare Mechanismen und Zellpopulationen zu identifizieren, die zum Beginn einer Erkrankung beitragen.
Die Forschung der Arbeitsgruppe fokussiert sich im Einzelnen auf folgende Themengebiete:
- TGF-β signaling und die Blut-Retinaschranke
- Regulation der Blut-Hirnschranke durch den Wnt7-Signalweg
- Mechanismen der Neurodegeneration und -protektion
- Mikrogliazellen im Rahmen vaskulärer Pathologie und Neurodegeneration
Um unsere wissenschaftlichen Fragestellungen zu adressieren, nutzen wir transgene Mäuse und konditionelle Knockout Maus-Modelle, unterschiedliche in vivo Schadensmodelle und Zellkultursysteme, die wir mit in vivo Bildgebung, molekularbiologischen und (immun)histologischen Methoden analysieren.