Regulation der Blut-Hirn-Schranke durch den Wnt7-Signalweg
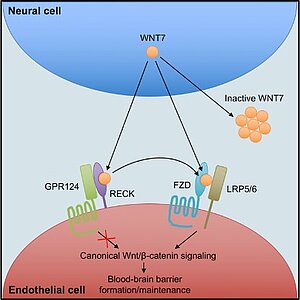
Abbildung: Regulation der Blut-Hirn-Schranke durch den Wnt7-Signalweg. Freies Wnt7 ist extrem instabil und bildet innerhalb kürzester Zeit nach Abgabe von neuralen Zellen inaktive Aggregate. Die transiente Bindung von Wnt7 an seinen hochselektiven Rezeptor RECK führt zur Wnt7-Stabilisierung und schließlich zur Übergabe an den klassischen Wnt-Rezeptor Frizzled (FZD). Auch der G-Protein-gekoppelter Rezeptor GPR124 spielt dabei eine essentielle Rolle, allerdings ist der Mechanismus noch unklar. Wnt7-vermittelte Heterodimerisierung der klassischen Wnt-Rezeptoren FZD und LRP5/6 führt dann zur Aktivierung des Wnt/b-catenin-Signalwegs und Bildung/Aufrechterhaltung der Blut-Hirn-Schranke. Aus Vallon et al., Cell Reports, 2018.
Eine Voraussetzung für die Entwicklung von Medikamenten, die die Blut-Hirn-Schranke (BHS) modulieren können (z.B. bei Schlaganfallpatienten), ist ein besseres Verständnis der molekularen Mechanismen der BHS-Regulation. Die physikalische Barriere der BHS beschränkt sich auf das Hirnendothel, das die Innenseite von Hirnblutgefäßen auskleidet. In den letzten Jahren wurden GPR124, ein G-Protein-gekoppelter Rezeptor der Adhäsionsfamilie, und das Zelloberflächenprotein RECK als essenzielle Regulatoren des Wnt7-Signalwegs im Hirnendothel identifiziert. Wnt7 ist ein spezieller Wachstumsfaktor, der von bestimmten Zellen der neurovaskulären Einheit, insbesondere Astrozyten, abgegeben wird und parakrin die Bildung der Barrierefunktion im Hirnendothel (BHS) vermittelt. Um die molekularen Mechanismen des Wnt7-Signalwegs besser zu verstehen, wenden wir zell- und molekularbiologische Methoden (z.B. CRISPR/Cas9), sowie Proteinbiochemie (z.B. Affinitätschromatographie) und Mausgenetik (z.B. Gen-Knockouts) an. Unser Ziel ist es neue Protein-Protein Interaktion innerhalb des Wnt7-Signalwegs zu identifizieren und bekannte Interaktionen genauer zu charakterisieren, was zur Entwicklung von neuen BHS-modulierenden Medikamenten beitragen könnte.
Projektleiter: Dr. Mario Vallon
Projektmitarbeiter: Dr. Anja Schlecht, Laura Hannig (MSc), Robin Heiden (MSc), Jakob Bernhard (Doktorand)