Stammzellbiologie und Regenerative Medizin
Team:
Dr. Leyla Doğan leyla.dogan@uni-wuerzburg.de
Prof. Dr. P. Wörsdörfer philipp.woersdoerfer@uni-wuerzburg.de
Prof. S. Ergün sueleyman.erguen@uni-wuerzburg.de
Assoziiert (extern): F. Edenhofer
Kürzlich entwickelte Verfahren zur gezielten Reprogrammierung von Zellen eröffnen vielversprechende, bislang unzugängliche Anwendungsgebiete der Biomedizin. Patienten-eigene reprogrammierte Zellen wie z.B. induzierte pluripotente Stamm- (iPS-) Zellen stellen eine vielversprechende Grundlage für die Modellierung von Krankheiten und Entwicklung von Zell- und Gewebeersatztherapien dar. Unserer Arbeitsgruppe ist erstmalig die künstliche Herstellung von neuralen Stammzellen (iNS-Zellen) aus Bindegewebszellen der Maus gelungen. Diese künstlich hergestellten Zellen haben wir erfolgreich in Tiermodellen für Entmarkungskrankheiten verwendet. Des Weiteren identifizierte unsere Arbeitsgruppe in der Adventitia adulter menschlicher Blutgefäße eine Stammzellnische, die nicht nur vaskuläre, sondern auch nicht-vaskuläre Stamm- und Progenitorzellen beherbergt und von uns als „Vaskulogene Zone“ benannt wurde. Unsere Forschungen zielen auf die Reprogrammierung bzw. endogene Rekrutierung adulter Stammzellen des Zentralnervensystems und des kardiovaskulären Systems für die Zellersatztherapie.
Im Speziellen gehen wir folgenden Fragestellungen nach:
- Welche extrinsischen sowie intrinsischen Faktoren beeinflussen die direkte Reprogrammierung somatischer Zellen in adulte Stammzellen? (Fokus auf das Zentralnervensystem und Kardiovaskuläres System)
- Welche epigenetischen Mechanismen sind an der Zellkonvertierung beteiligt und durch welche molekularen Signale werden sie reguliert?
- Welche Rollen spielen die durch BMP, Shh, und Wnt induzierten Signalwege bei der Reprogrammierung von Zellen?
- Für welche differenzierten Zelltypen lassen sich Vorläufer- und Stammzellen in der vaskulären Adventitia identifizieren und welche Mechanismen kontrollieren deren Differenzierungsprozesse?
- Welches funktionelle Potential haben reprogrammierte neurale und kardiovaskuläre Zellen für Zellersatztherapien und die Krankheitsmodellierung?
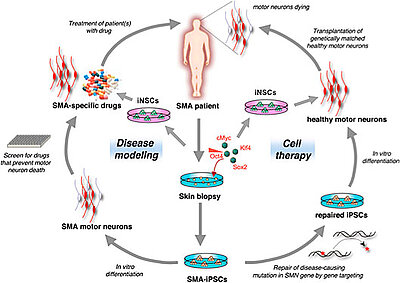
Abb. 1: Primärzellen z.B. aus der Haut oder Haarwurzel können in induzierte pluripotente Stamm- (iPS-) Zellen reprogrammiert werden, die sehr ähnlich zu embryonalen Stammzellen sind. Patienten-spezifische iPS-Zellen könnten für vielfältige biomedizinische Anwendungen herangezogen werden, wie z.B. Krankheitsmodellierung, drug screening, tissue engineering und Zellersatztherapie (modifiziert nach Stadtfeld & Hochedlinger, 2010)
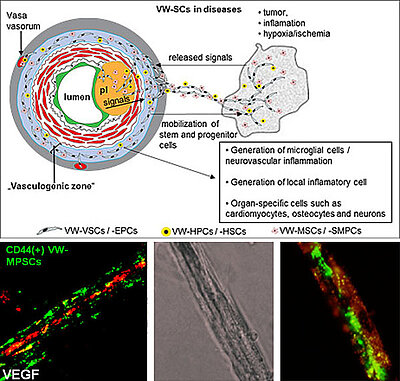
Abb. 2: Oben: Stamm- und Vorläuferzellen der adventitiellen „Vaskulogene Zone“ der Gefäßwand (VW-SCs) können in beide Richtungen mobilisiert werden: a) in die Umgebung der Gefäßwand, z.B. durch Signale, die im Falle einer Ischämie, Entzündung und/oder eines Tumors freigesetzt werden und b) in Richtung Gefäßlumen, z.B. durch Endothelschaden oder atherosklerotische Plaques. Unten: Adulte VW-SCs aus der Adventitia der menschlichen A. thoracica interna differenzieren in Perizyten/glatte Muskelzellen, die die in vitro gebildeten endothelialen Tubes durch HUVEC (in Kollagengel, nach Stimulation mit VEGF) ähnlich wie bei Perizyten ummanteln.
Film 1: Animation zur Protein-Transduktion als minimal-invasive Methode zur Manipulation von Stammzellen. Wir produzieren biologisch aktive, zell-permeable Proteine, um Zellen zu reprogrammieren, ohne sie genetisch verändern zu müssen.
Ausgewählte Publikationen:
Kadari A, Lu M, Ming Li, Sekaran T, Thummer R, Guyette N, Chu V, Edenhofer F.
Excision of viral reprogramming cassettes by Cre protein transduction enables rapid, robust and efficient derivation of transgene-free human iPS cells
Stem Cell Res. Ther. (2014) doi: 10.1186/scrt435.
Peitz M, Münst B, Thummer RP, Helfen M, Edenhofer F.
Cell-permeant recombinant Nanog protein promotes pluripotency by inhibiting endodermal specification
Stem Cell Res. (2014)doi:10.1016/j.scr.2014.02.006.
Harreither E, Rydberg HA, Åmand HL, Jadhav V, Fliedl L, Benda C, Esteban MA, Pei D, Borth N, Grillari-Voglauer R, Hommerding O, Edenhofer F, Nordén B, Grillari J.
Characterization of a novel cell penetrating peptide derived from human Oct4.
Cell Regeneration (2014) 3:2 doi:10.1186/2045-9769-3-2.
Sekaran T, Thummer R, Edenhofer F
Exploring the Neural Reprogrammome using Bioinformatics Approaches.
J Stem Cell Res Ther (2013) 3:146. doi: 10.4172/2157-7633.1000146
Zhang R, Mjoseng HK, Pells S, Besseling R, Velugotla S, Bauer N G, Tourniaire G, Duffy CRE, Serio A, Greenhough S, Armit C, Helfen M, Edenhofer F, de Sousa P, Bradley M.
A thermoresponsive and chemically defined hydrogel for long-term culture of human embryonic stem cells
Nature Communications (2013), 4, 1335–10. doi:10.1038/ncomms2341
Klein D, Benchellal M, Kleff V, Jakob HG, Ergün S.
Hox genes are involved in vascular wall-resident multipotent stem cell differentiation into smooth muscle cells
Sci Rep. 2013 Oct 22;3:2178. doi: 10.1038/srep02178
Thier M, Wörsdörfer P, Lakes YB, Gorris R, Herms S, Opitz T, Seiferling D, Quande T, Hoffmann P, Nöthen MM, Brüstle O, Edenhofer F.
Direct conversion of fibroblasts into tripotent neural stem cells
Cell Stem Cell (2012) 10(4):473-9. Epub 2012 Mar 22.
Klein D, Weisshardt P, Kleff V, Jastrow H, Jakob HG, Ergün S.
Vascular wall-resident CD44+ multipotent stem cells give rise to pericytes and smooth muscle cells and contribute to new vessel maturation
PLoS One. 2011;6(5):e20540. doi: 10.1371/ Epub 2011 May 26.
Ergün S, Tilki D, Klein D.
Vascular wall as a reservoir for different types of stem and progenitor cells
Antioxid Redox Signal. 2011 Aug 15;15(4):981-95. doi: 10.1089/ars.2010.3507. Epub 2011 Jan 7. Review
Patsch C, Peitz M, Otte DM, Kesseler D, Jungverdorben J, Wunderlich FT, Brüstle O, Zimmer A, Edenhofer F.
Engineering cell-permeant FLP recombinase for tightly controlled inducible and reversible overexpression in embryonic stem cells
Stem Cells 28 (2010) 894-902.
Klein D, Hohn HP, Kleff V, Tilki D, Ergün S.
Vascular wall-resident stem cells.
Histol Histopathol. 2010 May;25(5):681-9. Review.
Münst B, Patsch C, Edenhofer F.
Engineering cell-permeant proteins
J. Visual. Exp. (2009) Dec 28;(34). pii: 1627. doi: 10.3791/1627. www.jove.com
Tilki D, Hohn HP, Ergün B, Rafii S, Ergün S.
Emerging biology of vascular wall progenitor cells in health and disease
Trends Mol Med. 2009 Nov;15(11):501-9. doi: 10.1016/j.molmed.2009.09.004. Epub 2009 Oct 12. Review.
Ergün S, Hohn HP, Kilic N, Singer BB, Tilki D.
Endothelial and hematopoietic progenitor cells (EPCs and HPCs): hand in hand fate determining partners for cancer cells
Stem Cell Rev. 2008 Sep;4(3):169-77. doi: 10.1007/s12015-008-9028-y. Epub 2008 Jul 8. Review.
Bosnali M, Edenhofer F.
Generation of transducible transcription factors Oct4 and Sox2
Biol. Chem. 389 (2008) 851-861.
Thill M, Schlagner K, Altenähr S, Ergün S, Faragher RG, Kilic N, Bednarz J, Vohwinkel G, Rogiers X, Hossfeld DK, Richard G, Gehling UM.
A novel population of repair cells identified in the stroma oft he human cornea
Stem Cells Dev. 2007 Oct;16(5):733-45. Erratum in: Stem Cells Dev. 2007 Dec;16(6):1059. Kilic, Nerbil [added
Haupt S, Edenhofer F, Peitz M, Leinhaas A, Brüstle O.
Stage specific conditional mutagenesis in mouse embryonic stem cell-derived neural cells and post-mitotic neurons by direct delivery of biologically active Cre recombinase
Stem Cells 25 (2007) 181-188.
Nolden L, Edenhofer F, Haupt S, Wunderlich FT, Siemen H, Brüstle O.
Site specific recombination in human ES cells induced by cell permeable Cre recombinase
Nature Methods 3 (2006) 461-467.
Zengin E, Chalajour F, Gehling UM, Ito WD, Treede H, Lauke H, Weil J, Reichenspurner H, Kilic N, Ergün S.
Vascular wall resident progenitor cells: a source for postnatal vasculogenesis
Development. 2006 Apr;133(8):1543-51. Epub 2006 Mar 8.
Murakami M, Ichisaka T, Maeda M, Oshiro N, Hara K, Edenhofer F, Kiyama H, Yonezawa K, Yamanaka S.
mTOR is essential for proliferation and growth in early mouse embryos and embryonic stem cells
Mol. Cell. Biol. 24 (2004) 6710-6718.
Peitz M, Pfannkuche K, Rajewsky K, Edenhofer F.
Ability of the hydrophobic FGF and basic TAT peptides to promote cellular uptake of recombinant Cre recombinase: a tool for efficient genetic engineering of mammalian genomes
Proc. Natl. Acad. Sci. USA 99 (2002) 4489-4494.
Gehling UM, Ergün S, Schumacher U, Wagener C, Pantel K, Otte M, Schuch G, Schafhausen P, Mende T, Kilic N, Kluge K, Schäfer B, Hossfeld DK, Fiedler W.
In vitro differentiation of endothelial cells from AC133-positive progenitor cells
Blood. 2000 May 15;95(10):3106-12.
Rieger R, Edenhofer F, Lasmézas CI, Weiss S.
The human 37-kDa laminin receptor precursor interacts with the prion protein in eucaryotic cells
Nature Medicine 3 (1997) 1383-1388.